Maailman maiden hallitukset ovat tehneet ostosopimuksia rokotevalmistajien kanssa koronapandemiahätätilan varjolla. Tarkoitus on koronapiikittää koko maailman väestö kokeellisella, testivaiheessa olevalla mRNA-geeniteknologiapiikillä vähintään kahteen kertaan. Käytämme esimerkkinä Albaniasta — joka ei ole mukana Euroopan unionin koronapiikkien yhteishankintasopimuksissa — tietovuodettua ostosopimusta.
Ei ole tiedossa, onko Euroopan unionin koronapiikkivalmistajien kanssa solmima ostosopimus — jossa Suomi on mukana — sanasta sanaan sama kuin Albanian, Dominikaanisen tasavallan tai Brasilian. Pfizer Brasilian ja Latinalaisen Amerikan alueen entinen toimitusjohtaja Carlos Murillo on kuitenkin kertonut Brasilian senaatin Covid CPI -ryhmän (Covid Parliamentary Inquiry Commission) kuulemisessa Pfizerin asettaneen kaikille maille samat ehdot rokoteostosopimuksissa. Yleensä tämän tyyppiset sopimukset ovat standarditavaraa. Rokoteostosopimuksissa lähinnä määritelty ostohinta näkyy vaihtelevan maakohtaisesti.
Euroopan unionin sopimukset löytyvät komission sivuilta teksti osittain peitettynä. LISÄYS 15.9.2021 klo 18:31 Euroopan unionin komission ennakko-ostosopimukset löytyvät nyt myös tietovuotona UMV-lehdestä, ladattavina versioina.
Aloitamme ajattelun esittelemällä Suomessa mediapimennossa tehtyjä lakimuutoksia.
U-kirjelmä 39/2020 ja HE49/2021 vp
Valtioneuvoston vuoden takainen U-kirjelmä 39/2020 vp eduskunnalle komission ehdotuksesta Euroopan parlamentin ja neuvoston asetukseksi kliinisten tutkimusten tekemisestä ihmisille tarkoitetuilla lääkkeillä, jotka sisältävät muuntogeenisiä organismeja tai koostuvat niistä ja jotka on tarkoitettu koronavirustaudin hoitoon tai ehkäisyyn, ja tällaisten lääkkeiden toimittamisesta (COM(2020) 261 final) ennakoi koronan torjumiseen käytettyjen kokeellisten, edelleen testivaiheessa olevien koronapiikkien olevan potentiaalinen bioriski.
Bioriskiä kuvataan mm. Johns Hopkins Bloomberg School of Public Health / Center for Health Securityn julkaisussa 9.10.2018 Technologies To Address – Global Catastrophic Biological Risks (s. 45-47): ”Itsestään leviävät rokotteet” sekä Pfizerin omissa kliinisten tutkimusten selosteissa (s.67-69).
Kyseinen U-kirjelmä kertoo että ”tehokas ja turvallinen rokote virusta vastaan on komission mukaan paras tapa saada pandemiaan pysyvä ratkaisu, vaikkakin COVID-19-rokotteen kehittäminen on haastavaa monista syistä: rokotekehitykseen käytettävissä oleva aikataulu on tiukka, valmistajien alkukustannukset suuret ja epäonnistumisten todennäköisyys merkittävä.”
”Asetuksella poikettaisiin geenitekniikkadirektiivien mukaisista ilmoitus- ja hakemusmenettelyistä sekä ympäristöriskien arvioinnista, asetuksessa velvoitettaisiin kuitenkin jäsenvaltiot mahdollisuuksien mukaan toteuttamaan asianmukaiset toimenpiteet, joilla minimoidaan tutkimuslääkkeen suunnitellusta tai tahattomasta leviämisestä ympäristöön aiheutuvat ennakoitavissa olevat kielteiset ympäristövaikutukset.”
”Kliinisiä tutkimuksia, joille on myönnetty lupa direktiivin 2001/20/EY nojalla ennen kyseisen lakkautusilmoituksen julkaisemista, voitaisiin kuitenkin pätevästi jatkaa ja käyttää myyntilupahakemuksen tukena ilman direktiivin 2001/18/EY 6–11 artiklan tai direktiivin 2009/41/EY 6–13 artiklan mukaista ympäristöriskien arviointia ja/tai lupaa.” ”Ehdotetusta asetuksesta ei ole järjestetty julkista kuulemista, eikä komissio ole tehnyt siitä vaikutusarviota.” Nythän koronapiikeillä ei ole myyntilupaa, ainoastaan väliaikainen eräkohtainen hätätilakäyttölupa (EUA). Jokainen piikin ottanut on osallistunut massakenttäkokeeseen.
(LISÄYS 15.9.2021 klo 18:34 Osoittautui tarpeelliseksi lisätä tähän selostus EUAn ja CMAn eroista. Euroopan unionin lainsäädäntö mahdollistaa hätätilan yhteydessä ehdollisen myyntiluvan (Conditional Marketing Approval, CMA) menettelyn. CMA ei ole myyntilupa, vaan lupa käyttää auktorisoimatonta tuotetta hätätilan aikana. Jäsenmaat voivat omaksua EUAn niin halutessaan, mutta EUA on maakohtainen. CMA-hyväksyttyjä tuotteita kuten rokotteita monitoroidaan haitta-hyötysuhteen arvioimiseksi varsinaista myyntilupaa (Marketing Approval, MA) varten. EUAssa valmistaja ei ole vastuussa tuotteensa aiheuttamista haitoista, CMAssa on — paitsi jos muuta sovitaan. Kun kyseessä on hätätilannekäyttöön myönnettävä lupa ”sellaisen lääkkeen jakelun sallimiseksi väliaikaisesti, jolla ei ole myyntilupaa (direktiivin 2001/83 5 artiklan 2 kohta), EU:n lainsäädännössä edellytetään, että jäsenmaat vapauttavat valmistajan ja myyntiluvan haltijan hallinnollisesta ja siviilioikeudellisesta vastuusta, kun jäsenmaa suosittaa tai edellyttää tällaista hätätilannekäyttöä.”)
Joissakin tapauksissa koehenkilö voi erittää rokotteen tai lääkevalmisteen sisältämää virusta ympäristöönsä, jolloin lähiympäristö voi altistua tahattomasti testausvaiheessa olevalle valmisteelle, jonka mahdollisia haittavaikutuksia ei vielä tunneta.
GMO-valmisteiden tapauksessa tarvittavat riskinhallintatoimet, kuten ohjeistus henkilökunnalle ja tutkimuksen osallistujille, käsitellään yleensä lupaprosessiin sisältyvässä tapauskohtaisessa ympäristöriskinarvioinnissa, joka nyt jäisi pois GMO-säädöksiä koskevan poikkeamismenettelyn takia.
Tällöin ei myöskään arvioitaisi mahdollisuutta, voisiko GMO-rokotteen laajamittainen levittäminen väestöön aiheuttaa riskin, että GMO-rokotteesta siirtyisi rekombinaation kautta uusia haitallisia ominaisuuksia nykyisiin patogeeneihin. Nämä turvallisuusnäkökohdat olisikin otettava huomioon kliinisiä lääketutkimuksia koskevan lupamenettelyn yhteydessä, jos tutkimusvalmiste sisältää lisääntymiskykyisiä ja infektiivisiä GMO:ja ja koehenkilöt voivat niitä erittää.
Valtioneuvoston U-kirjelmä 39/2020 vp
U-kirjelmän pohjalta tehtiin esitys HE49/2021, joka tuli voimaan kesäkuussa 2021. HE49 esitti, että ”tietojen luottamuksellisuuden merkitsemistä ja vahvistamista koskevia säännöksiä muutettaisiin siten, että geenitekniikan lautakunta voisi vahvistaa salassapidon tiedoille, jotka voivat vahingoittaa toiminnanharjoittajan etuja.” Toiminnanharjoittaja tarkoittaa lääkeyhtiöitä ja rokotekehittelijöitä. Joskus tulevaisuudessa tulkintaa saatetaan venyttää tarkoittamaan myös vastuuviranomaisia ja hallitusta.
”Geenitekniikkasääntelyn alkuaikoina EU:ssa lähes kaikki kenttäkoehakemukset koskivat muuntogeenisillä kasveilla tehtäviä peltokokeita, mutta vuonna 2020 jätetyistä hakemuksista enää alle 10 % koski kasveja. Sen sijaan muuntogeenisiä organismeja sisältävillä lääkkeillä tai rokotteilla tehtäviä kliinisiä lääketutkimuksia koskevien hakemusten määrät ovat kasvaneet vuosi vuodelta.”
”Toistaiseksi EU:ssa on saanut [väliaikaisen, ehdollisen] myyntiluvan viisi muuntogeenisiä virusvektoreita sisältävää valmistetta ja viisi muuntogeenisiin soluihin pohjautuvaa valmistetta. Kaksi muuta myyntilupapäätöstä on tällä hetkellä vireillä. Myyntiluvan on saanut myös viisi ihmisrokotetta, joista osa on koronavirusrokotteita, sekä useita eläinrokotteita.” ”Lääkelainsäädännön nojalla kliinisistä lääketutkimuksista ei järjestetä yleisökuulemista.”
”Salassa voidaan myös pitää sellaisten luonnollisten henkilöiden nimet ja osoitteet, jotka osallistuvat selkärankaisilla eläimillä [kuten ihmisillä] tehtyyn testaukseen tai toksikologisten tietojen hankkimiseen geenitekniikkalain 17 ja 20 §:ssä tarkoitettuihin hakemusmenettelyihin liittyvissä tieteellisissä selvityksissä, kuten tieteellisissä lausunnoissa. Koska henkilötietojen julkistamisen voitaisiin katsoa tällaisessa tilanteessa vahingoittavan merkittävästi kyseisten luonnollisten henkilöiden yksityisyyttä ja koskemattomuutta, niitä ei edellytettäisi asetettavaksi julkisesti saataville, jollei henkilötietojen suojaa koskevissa säädöksissä toisin säädetä.”
Salassa pidettävää tietoa on mm.
”1) valmistus- ja tuotantoprosessi, mukaan luettuna menetelmä ja sen innovatiiviset näkökohdat sekä muut tekniset ja teolliset eritelmät, jotka kuuluvat olennaisena osana mainittuun prosessiin tai menetelmään, lukuun ottamatta turvallisuuden arvioinnin kannalta olennaisia tietoja;
2) tuottajan tai maahantuojan kaupalliset yhteydet toiminnanharjoittajaan tai luvan haltijaan;
3) kaupalliset tiedot, joista käyvät ilmi toiminnanharjoittajan hankintalähteet, markkinaosuudet tai liiketoimintastrategia;
4) DNA-sekvenssiä koskevat tiedot, lukuun ottamatta muunnostapahtuman havaitsemis-, tunnistamis- ja kvantifiointimenetelmissä käytettyjä sekvenssejä;
5) jalostusmallit ja -strategiat.”
”Asetuksen edellyttämien muutosten lisäksi muuntogeenisilla organismeilla tehtäviä kenttäkokeita koskevaa yleisön kuulemisaikaa lyhennettäisiin 60 päivästä 30 päivään. Tietyissä tilanteissa kuulemista ei tarvitsisi järjestää lainkaan. […] Direktiivi sääntelee muuntogeenisten organismien tarkoituksellista levittämistä ympäristöön. Avoimella käytöllä tarkoitetaan muuntogeenisillä organismeilla tehtäviä kenttäkokeita ja niitä sisältävien tuotteiden markkinoille saattamista. Kenttäkokeet voivat olla esimerkiksi viljelykasvien peltokokeita tai kliinisiä lääketutkimuksia. (Muuntogeenisellä organismilla tarkoitetaan geenitekniikkalain (377/1995) 3 §:ssä määriteltyä eliötä, jonka perintöainesta on muutettu tavalla, joka ei toteudu luonnossa pariutumisen tuloksena tai luonnollisena yhdistelmänä).”
”Kenttäkokeissa on useimmiten kyse joko kliinisistä lääketutkimuksista tai sellaisen lääkevalmisteen erityisluvallisesta käytöstä, jonka myyntilupaprosessi lääkelainsäädännön nojalla on kesken” — kuten esimerkiksi koronapiikkien kohdalla on asian laita.
”Muuntogeenisiä organismeja sisältäviä lääkevalmisteita ja rokotteita kehitetään kiihtyvään tahtiin, ja useat valmisteet ovat jo saaneet myyntiluvan maailmalla tai EU:ssa. Geenitekniikkalakia ei sovelleta myyntiluvan saaneisiin muuntogeenisiä organismeja sisältäviin lääkkeisiin ja -rokotteisiin, jos niitä käytetään myyntiluvan ehtojen mukaisesti. Tutkimus- ja tuotekehitysvaiheessa sekä eräissä muissa käyttötilanteissa muuntogeenisiä organismeja sisältäviin lääkkeisiin ja -rokotteisiin sovelletaan kuitenkin geenitekniikkalain 4 ja 5 luvun mukaisia ilmoitus- ja lupamenettelyjä. Tällaisia tilanteita ovat:
- lääkevalmisteeseen tai rokotteeseen tarkoitettujen muuntogeenisten organismien tutkimus tai niiden tuottaminen tutkimustarkoituksiin
- prekliiniset eli kliinistä koetta edeltävät tutkimukset
- kliiniset lääketutkimukset muuntogeenisiä organismeja sisältävillä lääkevalmisteilla tai –rokotteilla, joilla ei ole myyntilupaa tai kun lääketutkimuksessa poiketaan myyntiluvan ehdoista
Esityksestä on lausunnot mm. Rokotetutkimuskeskukselta ja Lääketeollisuus ry:ltä, jotka ovat edunsaajia.
”Suuri osa kliinisistä lääketutkimuksista Suomessa tehdään ulkomaisten lääkeyritysten toimeksiannosta. Suomalaiset osapuolet ovat tällöin yleensä alan asiantuntijapalveluita tarjoavia yrityksiä, jotka hoitavat tutkimuksen lupamenettelyt viranomaisten kanssa. Käytännön kliininen tutkimus tehdään tyypillisesti yliopistollisissa sairaaloissa tai muissa terveydenhuollon yksiköissä” millä tarkoitettaneen lastenneuvoloita, jotka hoitavat värväämisen ja piikitykset.
”Ehdotetuilla muutoksilla voi olla vaikutusta geenitekniikan lautakunnalle jätettävien kenttäkoehakemusten määrään, jos yleisön kuulemisajan lyhentäminen ja EU:n lääke- ja geenitekniikkasäädöksiä koskevan harmonisointityö lisäävät lääkeyritysten kiinnostusta järjestää kliinisiä lääketutkimuksia entistä useammissa EU:n jäsenvaltioissa.”
”Koronarokotteiden kansainväliset tutkimukset jatkuvat myyntiluvan saamisen jälkeen. Rokotettujen seuranta on kaiken kaikkiaan suunniteltu jopa kahden vuoden kestoiseksi. Myös Suomessa THL on käynnistämässä koronarokotteiden turvallisuuden ja vaikutusten seurannan”, uutisoi Yle 14.12.2020. Jokainen piikin ottanut tuskin on ymmärtänyt osallistuvansa laajan mittakaavan kenttäkokeeseen.
”Lääkevalmisteiden teho ja haittavaikutukset voivat vaihdella potilaan geneettisten ominaisuuksien perusteella ja suomalaisen väestön geeniperimä poikkeaa esim. eurooppalaisesta. Näin ollen suomalaisten potilaiden osallistuminen lääketutkimuksiin auttaisi osaltaan arvioimaan, onko tietystä muuntogeenisiä organismeja sisältävästä lääkevalmisteesta tai rokotteesta mahdollisesti hyötyä myös suomalaisille potilaille”, kuvailee HE49/2021 vp.
”Rokotevastaisten kampanjoiden seurauksena kansalaiset saattaisivat tulevaisuudessa kiinnostua esittämään enemmän huomioita muuntogeenisiä organismeja sisältävillä rokotteilla ja lääkkeillä tehtävistä tutkimuksista. Kuulemisesta luopuminen on siten erityisen perusteltua tiettyihin lääketieteellisiin toimenpiteisiin, hoitoon tai tutkimuksiin osallistuvien henkilöiden terveyden tai yksityisyyden suojan turvaamiseksi, vaikka se rajoittaisi yleisön osallistumismahdollisuutta näissä tilanteissa,” esitti Sanna Marinin (sdp/WEF) hallitus.
Kaiken kaikkiaan presidentti Sauli Niinistön (kok) vahvistamilla muutoksilla on tähdätty siihen, että laajamittaiset kenttäkokeet geeniteknologioilla voidaan hoitaa vailla huomiota, suojaten tekijöitä ja estää riippumaton arviointi. Jokainen on koehenkilö tässä kenttäkokeessa.
Suomessa on siis hyväksytty lakimuutos tietäen kokeellisella mRNA-geeniteknologialla koronapiikitettyjen mahdollisesti väestölle muodostama bioriski, ja tietäen, että koronapiikitykset eivät pysäytä väitettyä epidemiaa vaan että seuraus saattaa olla päinvastainen.
Miksi jotain näin järjen, moraalin ja oikeusperiaatteiden vastaista on tehty?
Sopimus
Todennäköisin syy järjen vastaiselle toiminnalle löytyy sopimuksista. Puran tähän Albanian sopimuksesta suomalaisten kannalta kiinnostavat kohdat.

Kaikki sopimukseen liittyvä tieto on luottamuksellista ellei sen kertomista poikkeuksella sallita; jos tieto on jo julkisesti saatavilla, sen voi mainita (s. 2-3). ”Tuotteella” tarkoitetaan kaikkia tuotettuja rokotteita kokonaan tai osittain tuotettuna tai toimitettuna, suoraan tai epäsuorasti Pfizerin tai BioNTechin tai kumppaniensa toimesta SARS-Cov-2 viruksen ja/tai kaikkien sen sukuisten kantojen, mutaatioiden, [keinotekoisesti tuotettujen] modifikaatioiden tai johdannaisten estämiseen. Vastuuvapaus ja syytesuoja ilman rajoituksia. Vastuuvapaus ja syytesuoja ”rokotteen” ainesosien, teknologioiden ja tuotteiden, joita on käytetty tehostamaan vaikutusta, seurausten suhteen. Osaa aineista ei ole tarkoitettu ihmiskäyttöön.




Vaikka löytyisi tai kehitettäisiin tai olisi olemassa toimiva muu lääke Covidiin, Pfizerin kanssa solmittua sopimusta rokoteostoista ei voi purkaa. Pfizer ei ole missään vastuussa, vaikka se ei toimittaisikaan tilattua tuotetta sovitussa aikataulussa, eikä Pfizerin epäonnistuminen ole peruste purkaa sopimusta kuten ei myöskään Pfizerin tai sen kumppanien epäonnistuminen myyntiluvan hankkimisessa.
Kohdassa 2.5 Product Shortages (a) ja (b) vielä täsmennetään Pfizerin päättävän, paljonko ostaja[valtio] saa tilaamastaan ja milloin; ostaja luopuu oikeuksistaan turvautua lakiin Pfizerin epäonnistuessa toimituksissa.
Missään olosuhteissa Pfizer tai sen kumppanit eivät ole vastuussa, jos tuotetoimitukset viivästyvät; rangaistusmaksuja ei saa asettaa. Kohta 2.8 ”Title to Product, Risk of Loss” (d) määrittää, ettei Pfizer hyväksy missään olosuhteissa ”rokotteen”/”tuotteen” yhdenkään annoksen palauttamista.
Sopimuksessa myönnetään Pfizerille, sen alihankkijoille ja kumppaneille täysi vastuuvapaus epäonnistumisesta toimituksissa syystä mistä hyvänsä. Vaikka olisi olemassa toimiva lääke Covidiin — kuten hydroksiklorokiini, ivermektiini tmv — tilatut rokotteet on lunastettava. Sopimus myöntää vastuuvapauden myös ”rokotteessa”/”tuotteessa” vaikutusta tehostamaan käytettyjen ainesosien, teknologioiden ja tuotteiden seurausten suhteen.
Eräs tällainen ainesosa on keinotekoisesti luotu koronaviruksen piikkiproteiinin osan koodi. Koska koodi on liikesalaisuus, kukaan ei tosiasiassa tiedä mitä häneen piikitetään. Ja vaikka se selvitettäisiin ja kerrottaisiin, sillä ei ole merkitystä, sillä sopimuksessa määritellään myös, että Pfizer saa muuttaa tuotetta yksipuolisesti, (”kehitystyö jatkuu” sopimuksen solmimisen jälkeen). Koska koodi on synteettinen ja kokeet kesken (koronapiikityskampanja on osa koetta), turvallisuutta ei voida taata koska toimintamekanismi ei ole edes valmistajan tiedossa. Kehon turvamekanismit ohitetaan piikittämällä synteettinen koodi kehoon.
Ostaja[valtio] tunnustaa, että ”rokotteen” pitkäaikaisvaikutukset ja tehokkuus eivät ole tiedossa.
British Medical Journal (BMJ) arvioi artikkelissa ”The EMA covid-19 data leak, and what it tells us about mRNA instability” Euroopan lääkevalvontavirasto EMAn hakkeroinnissa saatua Pfizer/BioNTechin koronapiikkiä koskevaa dataa. BMJ:n mukaan lääkevalvojilla oli suuri huoli koronapiikin mRNAn, siis synteettisen piikkiproteiinin epävakaudesta. Osa synteettisestä koodista ei ollut ehyttä vaan turmeltunutta. mRNA-koronapiikkien idea on nimenomaan viedä nanolipidipakattu (LNP) koodi soluun, jotta koodi ohjelmoi solut tuottamaan piikkiproteiinia, jotta vasta-aineita alkaisi valmistua.
Tietokoneiden kanssa töitä tekevät tietänevät, mitä turmeltunut koodi tekee koneen toiminnalle. Yhdessä koronapiikkiannoksessa on kymmeniä biljoonia ellei triljoonia nanolipidipakattuja koodeja. Jos edes 10% määrästä on turmeltunutta koodia, solujen saamien virheellisten ohjeiden määrä on valtava, eikä kukaan tiedä, mitä ne pitkässä juoksussa ohjaavat solut tekemään. Saamme tulevaisuudessa nähdä uusia, jännittäviä oireyhtymiä, on hyvä arvaus.
Ranskalainen Le Monde on uutisoinut samaisiin hakkeroituihin, vuodettuihin sähköposteihin nojaten EU-komission – pääkomissaari Ursula von der Leyenin johdolla – painostaneen Euroopan lääkevirastoa EMAa hyväksymään Suomessakin käytössä olevat Pfizer/BioNTechin ja Modernan koronarokotteet nopeutetussa menettelyssä.
Pfizerin ”rokotteita” ei myöskään sarjoiteta (*tietorakennetta tai objektitilaa ei muunneta muotoon, joka voidaan tallentaa tai lähettää ja rekonstruoida myöhemmin), joten jälkikäteen on mahdoton selvittää kuka sai mitäkin, ja mitä niissä oli. Normaalisti kaikki lääkkeet sarjoitetaan. ”Rokotteeseen” tehdyistä (tai vahingossa syntyneistä) muutoksista ei ilmoiteta; ”rokotetut” eivät tiedä, mitä heihin piikitetään. Lain edellyttämä tietoinen suostumus (Informed Consent) ei voi toteutua. Kuinka paljon Suomessa on ihmisiä, jotka uskovat koronapiikin olevan tutkitusti tehokas ja turvallinen? Monelleko piikitettävälle pistoksen antaja on kertonut ADEn riskistä ja lukuisista muista haittavaikutuksista ennen piikin tuikkaamista?

Ostaja[valtio] maksaa tilaamansa annokset, tarvitsi niitä tai ei (6.2 ”Termination for Cause”, 6.5 ”Effects for Termination”).
Edelleen ostaja[valtio] sitoutuu suojaamaan Pfizerin ja koko ketjun toimijat kaikilta syytteiltä, valituksilta, vaatimuksilta, rangaistuksilta, sakoilta, kuluilta, tappioilta ymv. joita saattaa seurata ”rokotteesta” ja/tai sen käytöstä sekä kustantamaan tarvittaessa Pfizerin ja sen yhteistyökumppanien puolustuksen. Pfizer kontrolloi puolustusta.
Kohdassa 9.1 ”Insurance” ilmoitetaan, ettei Pfizer eikä sen kumppanit ole korvausvastuussa tuotteensa aiheuttamista haitoista. Tässä on syy siihen, miksi hallitus esitti ja eduskunta hyväksyi rokotehaittojen korvaamisen valtion toimesta, siis veronmaksajien rahoilla: kokeellisten, keskeneräisten piikkien kohdalla riski on tuntematon ja vakuutusyhtiöiden mielestä liian suuri.

Sopimus takaa Pfizerille, että sopimus — ja Pfizer kumppaneineen siinä ohessa — on kaikkien paikallisten lakien yläpuolella ja koskematon, ja se vahvistetaan uudelleen kohdassa 9.5 ”Conditions Precedent to Supply” samoin kuin kaikkien Pfizerille ja sen kumppaneille koituvien tappioiden ja menetysten korvaaminen. Sama toistetaan pykälässä 12.6 (a) ja (b), Third Party Rights.
3.4 Taxes (s.18-19) määrittelee, ettei Pfizer maksa arvonlisäveroa tai muita vastaavia veroja eikä muitakaan veroja, tulleja tai muita maksuja, joita ”tuotteen” valmistamisessa ja jakelussa normaalisti syntyisi. Pfizer voi muuttaa ilmoituksella tuotteen valmistuksen ja jakelun laadunvalvontaa (4.1 Manufacturing Standards) kun taas ostajavaltio takaa Pfizerille ja sen kumppaneille kaikki tarvittavat luvat.
Sopimus on pidettävä salassa 10 vuotta (10. ”Confidential Information”, 10.4 ”Survival”).

Kohdassa”Insurance and Liability”, 9.4 ”Waiver of Sovereign Immunity” määritellään ostajavaltion luopuvan peruuttamattomasti suvereenista immuniteetistaan itsensä ja varojensa, joita sillä on tai se voi tulevaisuudessa saada, suhteen taipuen kiistatapauksissa newyorkilais-välitystuomioistuimien päätökseen kiista-asioissa. New Yorkin tuomioistuimet ovat taho, joka jäädyttää valtioiden varat mikäli Pfizerilla on saatavia ko. valtiolta.
Sopimuksessa edellytetään myös ostaja[valtio]n huoletivan sellaisen lainsäädännön tai sääntelyn ja rahoituksen implementoimisesta ja ylläpitämisestä, että sopimuksen ehdot täyttyvät.

Tarttuvuus ja variantit
7. syyskuuta 2021 päivätyssä hallituksen esityksessä HE 118/2021 vp. uusimmista muutoksista tartuntatautilakiin syyllistetään rokottamattomia tartuntalähteinä — vaikka koronapiikkien tehon suhteen perusteluihin kirjattu on epäilyksiä.
Perusteluissa kerrotaan myös, että ”[…] Väestön rokotuskattavuuden lisääntyessä lieväoireisten ja oireettomien tartuntojen osuus kasvaa, mikä vähentää testiin hakeutumista. Myös testauksen kohdentaminen rokottamattomiin henkilöihin merkitsee sitä, ettei tartuntoja enää välttämättä havaita samalla tavalla ja että ilmaantuvuus yksinomaan ei riittävällä tavalla kuvaa epidemiatilannetta.
Tartuntojen jäljitettävyys on tartuntojen torjunnan kannalta keskeinen tekijä […] Tartuntojen määrä alkoi heinäkuusta alkaen nousta erityisesti uuden deltavariantin levitessä rokottamattomassa väestössä, mutta vaikeaa sairaalahoidon kuormitusta ei ole enää ilmaantunut […].” Rokottamattomat eivät siis helposti päädy sairaalaan varianttien takia.

”Ineffective neutralization of the SARS-CoV-2 Mu variant by convalescent and vaccine sera” -tutkimus Japanista osoittaa Myy-variantin olevan vastuskykyinen eritoten Pfizerin koronapiikille. Kun Myy alkaa kiertää piikitetyssä väestössä, nopeasti kiertävät variantit ovat valikoituneet rokotteita väistäviksi. Niiden torjuminen rokottamalla tuskin onnistuu. Massapiikitykset epidemiatilanteissa ovat omiaan synnyttämään tällaisia väisteleviksi kehittyneitä variantteja, mikä synnyttää tarpeen tartuntaketjujen katkaisemiselle muilla keinoin, tässä tapauksessa koronapiikitettyjen eristämisellä muusta yhteisöstä, kuten Ranskan rokoteohjelman entinen johtaja Christian Perronne hahmotteli. Rokotteilla luotiin riskiryhmä, Perronne sanoo.
Yllä kerrotun perusteella asian voi nähdä niin, että rokotevalmistajien kanssa solmitut, salaisiksi määrätyt sopimukset pakottivat ostajavaltiot lakimuutoksiin.
Lakimuutokset mahdollistavat laajamittaiset kenttäkokeet testaamattomilla tuotteilla väestölle kertomatta, väestöä kuulematta. Sekä yksilökohtaiset että väestötason riskit piilottaen.
Lakimuutokset toimivat samalla koronapiikkivalmistajien vastuuvapauslausekkeena, onhan toiminta hallituksen esityksestä ja eduskunnan suostumuksella laillistettu.
Seuraukset Suomessa
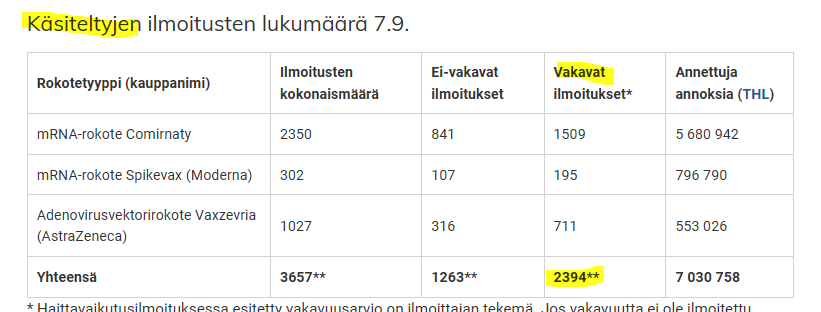
Fimeassa on 7.9.2021 mennessä käsitelty 117 koronarokotuksiin liittyvää haittavaikutusilmoitusta, joissa kerrotaan potilaan menehtyneen. Yhdeksän potilaista oli saanut Modernan Spikevaxin, 16 AstraZeneca/Oxfordin Vaxzevrian ja loput 92 Pfizer/BioNTechin Comirnatyn. Modernan kliiniset kokeet päättyvät kahden vuoden päästä.
Tarkempaa käsittelyä odottavia koronarokotehaittailmoituksia on n. 11 000, joista pääosin ilmoittajan vakavaksi luokittelemia on noin 520. Yksi ilmoitus sisältää keskimäärin viisi epäiltyä haittavaikutusta, joten ilmoitettujen haittojen määrä on suurempi kuin ilmoitusten määrä.
12-17 vuotiaiden haitoista kerrotaan, että Fimeaan on 7.9.2021 mennessä tullut 171 haittavaikutusilmoitusta 12-17-vuotiaista, joista 82 on saanut Comirnatyn ja 89 Spikevaxin. 121 näistä ilmoituksista koskee 12-15-vuotiaita, ja 50 16-17-vuotiaita. Noin 70 % ilmoituksista oli kuluttajilta, loput terveydenhuollon ammattilaisilta. Haitan on arvioitu olevan vakava 30 ilmoituksessa. Nuorten koronapiikitykset aloitettiin Suomessa Marinin hallituksen voimassa olevan lain vastaisella asetuksella 9.8.2021. Koronapiikitykset ovat siten aiheuttaneet enemmän haittaa kuukaudessa kuin itse lieväoireinen tauti 19 kuukaudessa.

MIT-tutkija Stephanie Seneff yhdessä naturopaatti-onkologi Greg Nighin kanssa kiinnitti toukokuussa 2021 huomiota siihen, ettei milloinkaan aiemmin ole sovellettu mRNA-geeniteknologiaa tavallisen infektiotaudin torjumiseen, ja vain alustavan esikliinisen datan pohjalta. Milloinkaan aiemmin ei ole laajoihin väestöihin injektoitu geenimuunneltuja polynukleotideja ja allergeeniksi tunnettuja PEGylaatteja, ja kehotettu odottamaan haittavaikutuksia.
Euroopan unionin lääkevalvontavirasto EMA tutkii parhaillaan uusia koronapiikkihaittoja kuten kuukautishäiriöt, allergiset ihoreaktiot (monimuotoinen punavihoittuma erythema multiforme), munuaiskerästulehdus (glomerulonefriitti), munuaistulehdus ja munuaishäiriö, jossa virtsatessa poistuu suuria määriä proteiineja (valkuaisvirtsaisuus, proteinuria).
Mahdollisuus irtautua?
Ostajavaltioiden on lähes mahdoton irtautua sopimuksesta, Pfizerin laita on toisin. Pfizerin irtautumiseen riittää yksipuolinen ilmoitus. Ostaja kykenee hylkäämään tuotteen vain, jos voi osoittaa materiaalisen rikkeen cGMP-prosessissa (“Current Good Manufacturing Practices”), määrittelee kohta 4.4 ”Rejection of Product; Disposal of Rejected Shipments”. Huomautus on tehtävä 24 tunnin kuluessa tuotteen vastaanottamisesta. Rikkeen osoittaminen voi olla vaikeaa, koska teknologiaa, valmistusprosessia ymv. koskevat tiedot ovat liikesalaisuuksia — sen ohella, että cGMP:ta valvoo Yhdysvaltain lääkevalvontavirasto FDA. Voiko FDA:lla olla valvontaprosessi asiasta, koska cGMP:ta ei ole koskaan sovellettu mRNA-teknologiaan; mRNA-geeniteknologiaa ei ole aiemmin tuotettu kaupallisessa tuotannossa?
Journalisti Miklos Omolnomarin Feketen Feheren (Black and White)-blogi kuuluu kertoneen 28. huhtikuuta 2021 EU:n terveyskomissaari Stella Kyriakideksen, joka hoiti EU:n koronapiikkitilaukset, ottaneen lahjuksia lääkeyhtiöiltä 4 miljoonan euron edestä. Rahat maksettiin EU-jäsenmaan, verokeidas Kyproksen kautta, näin kertovat V4 Agency-, Newsbeezer– sekä Nova24-tv -sivustot.
Sopimuksen kohdassa 5.3 ”Anti-Bribery/Anti-Corruption and Global Trade Controls” Pfizer sitoutuu olemaan lahjomatta virkamiehiä, poliitikkoja, puolueita sekä sopimattomasti vaikuttamatta päätöksentekoon. Jos Kyriakideksen rahoja on tullut taparikollinen Pfizerilta, sen alihankkijoilta tai kumppaneilta, siinä on kenties mahdollisuus päästä sopimuksesta eroon — jos terveyskomissaarin saama ”laina” tuli Pfizerilta tai sen kumppaneilta.
Pilkkutietona mainittakoon vielä, että EU:n rokoteostoista päättävän pääkomissaari Ursula von der Leyenin puoliso Heiko von der Leyen on Orgenesiksen, amerikkalaisen geeniterapiaan erikoistuneen, verokeitaisiin sijoittuneen bioteknologiayhtiön lääketieteellinen johtaja. Koronapiikkiä kehittävän Orgenesiksen varatoimitusjohtaja Vincent Vandam että Heiko von der Leyen ovat työskennelleet aiemmin yhdessä GlaxoSmithKlinella (GSK), ja Vandam myös Pfizerillä. (Toim.huom. Orgenesiksestä tulee mieleen sanapari orgaaninen + genesis, ihmisen luominen. Mutta millaisen ihmisen? Orgenesis on geeniteknologiayhtiö.)
LISÄYS 15.9.2021 klo 18:51 UMV-lehti on julkaissut tietovuotona saadut, Euroopan komission tekemät ennakko-ostosopimukset (Advance Purchase Agreement, APA) eri koronapiikkivalmistajien kanssa. Saatavilla on myös Pfizer Analyze -tietovuodon materiaalit eri maiden kanssa solmituista sopimuksista. Vertailu on nyt mahdollista. Palaan asiaan erillisessä tekstissä, kun olen lukenut sopimukset läpi.
Aiheeseen liittyy:

Declaration Under the Public Readiness and Emergency Preparedness Act for Medical Countermeasures Against COVID-19 Yhdysvaltain PREP-Act, jolla rokotevalmistajat vapautetaan vastuusta ja korvauksista haittojen suhteen.
sekä
WION: How Pfizer tried to bully Argentina and Brazil in exchange for vaccines
International Journal of Vaccine Theory, Practise and Research (IJVTPR): Worse Than the Disease? Reviewing Some Possible Unintended Consequences of the mRNA Vaccines Against COVID-19
AvoinMedia: Lääketeollisuuden piilotettu vaikutus politiikkaan
Ike Novikoff: 1.9.2021 haastattelu E-P koronanyrkki, infektioylilääkäri Elina Kärnä
Euroopan parlamentin lainsäädäntöpäätöslauselma 10. heinäkuuta 2020 ehdotuksesta Euroopan parlamentin ja neuvoston asetukseksi kliinisten tutkimusten tekemisestä ihmisille tarkoitetuilla lääkkeillä, jotka sisältävät muuntogeenisiä organismeja tai koostuvat niistä ja jotka on tarkoitettu koronavirustaudin hoitoon tai ehkäisyyn, ja tällaisten lääkkeiden toimittamisesta (COM(2020)0261 – C9-0185/2020 – 2020/0128(COD))

Ympäristöministeriö, Suomen ympäristökeskus, FIMEA): Kliinisten tutkimusten tekeminen ihmisille tarkoitetuilla lääkkeillä, jotka sisältävät muuntogeenisiä organismeja tai koostuvat niistä ja jotka on tarkoitettu koronavirustaudin hoitoon tai ehkäisyyn, ja tällaisten lääkkeiden toimittaminen, asetus
Artikkelikuva: Tuntematon some-taiteilija
LISÄTTY 12.9. 2021 klo 07:33 ”Aiheeseen liittyy” -osaan materiaalia
LISÄTTY 12.9.2021 klo 22:53 kolme linkkiä
KORJATTU 14.9.2021 klo 21:34 kohta ”Pfizerin ”rokotteita” ei myöskään sarjoiteta (tietorakennetta tai objektitilaa ei muunneta muotoon, joka voidaan tallentaa tai lähettää ja rekonstruoida myöhemmin), joten jälkikäteen on mahdoton selvittää kuka sai mitäkin, ja mitä niissä oli. Normaalisti kaikki lääkkeet sarjoitetaan.” Alkuperäisessä tekstissä puhuin sarjanumeroinnista, mikä oli väärin, harhauttavaa ja sekoittavaa. Pahoittelen virhettä. Huomasin sen ehdittyäni ensimmäisen kerran viikkoon nukkua yli kolme tuntia.


Pirkanmaan outo tilanne: yhä useampi saanut rokotuksen – ja yhä useampi saa viruksen
Seitsemän vuorokauden ilmaantuvuus nyt jopa 70 prosenttia korkeampi kuin pari viikkoa sitten.
https://www.is.fi/tampereen-seutu/art-2000008252037.html
TykkääTykkää
Länsi-Virginian kuvernöörin tiedotustilaisuus:
* 26% lisäys uusissa tapauksissa täysin rokotetuissa
* 21% lisäys läpivuototapausten sairaalahoidossa
* 25% lisäys täysin rokotettujen tautikuolemissa
8 viikon aikana
Suomi: variantit eivät tartu helposti rokottamattomiin
TykkääTykkää
UMV-lehti on juuri julkaissut tukun tietovuodettuja sopimuksia https://mvlehti.net/2021/09/14/tietovuoto-kaikki-eun-ja-koronarokotteiden-valmistajien-salatut-sopimukset-pdf/
Nyt päästään suorittamaan vertailuja.
———–
EDIT. Luin juuri Pfizerin ja EU:n sopimuksen pikaisesti läpi. Muotoilu hieman poikkeaa mutta varsinainen sopimussisältö on sama eli piikkitehtailla ei ole mitään vastuuta vahingoista jne.
TykkääLiked by 1 henkilö
Pirkanmaalla testausmäärät kasvussa kun flunssaa liikkeellä ja epäluotettava pcr testi antaa vääriä positiivisia. Talvea kohden flunssat lisääntyy joten käppyrät saadaan takuuvarmasti nousuun kautta maan.
Jos jollekkin vielä epäselvää mikä petos ja suuri huijaus on maassamme käynnissä, voi tehdä itselleen ”reality checkin” kysymällä:
Onko muita lääkkeitä taudin ehkäisyyn tarjolla, kuin artikkelissa mainittu geenimanipulaatiococtailinjektio?
TykkääTykkää
Yhdysvalloissa ei enää ole flunssaa 😀
TykkääTykkää
Israelissa sitten senkin edestä… rokotetuilla nimittäin. Israelin heinäkuu Haisee ADE-ilmiölle
TykkääTykkää
Olipa taas analyyttinen ja perusteellinen kirjoitus. Kiitos!
TykkääTykkää
Ei kestä. Minä toimitan materiaalia, ihmiset hoitavat ajattelutyön itse. Niin se sujuu 😉
TykkääTykkää
HALLITUKSET ja SUURYHTIÖT ovat SAMA ASIA. ROTHSCHILDIT ja ROCKEFELLERIT omistavat KAIKEN. Hallitukset, yliopistot, TIETEEN, THL:n, oikeuslaitoksen jne. Sannan ja hänen pomonsa ministeri KIURUN päämäärä on TUHOTA Suomen TALOUS ja siirtää Suomi SOSIALISTISEEN sidosryhmätalouteen. KORONAOHJEET tulevat suoraan ulkomaan METKUSEDILTÄ. Big Banks ja Big Pharma ovat RIKOLLISJÄRJESTÖJÄ. Olemme tekemisissä AMMATTIRIKOLLISTEN kanssa. Kun seuraavan kerran pääsette ÄÄNESTÄMÄÄN miettikää haluatteko Suomesta AUSTRALIAN? Eli PÄÄTTÄJÄT, VIRKAMIEHET ja miljoonilla ostetut ”ASIANTUNTIJAT” vaihtoon!
TykkääTykkää
”Rokotevastaisten kampanjoiden seurauksena kansalaiset saattaisivat tulevaisuudessa kiinnostua esittämään enemmän huomioita”
Olisipa kamalaa, jos syntyisi vapaata keskustelua tyrkytetyistä rokotteista ja lääkkeistä. Tuohan on kansalaisten tiedonsaannin ja asiaan perehtymisen estämistä. Kaukana tiedonsaannin ja sananvapauden kunnioittamisesta.
No, niinhän tuo viherfasismi toimii, joten ei yllätä.
TykkääTykkää
[…] Haluatko tietää, mitä hallitukset ovat sopineet rokotevalmistajien kanssa? – artikkeli (lisätty […]
TykkääTykkää
[…] Haluatko tietää, mitä hallitukset ovat sopineet rokotevalmistajien kanssa? – artikkeli (lisätty […]
TykkääLiked by 1 henkilö
Nyt se vihdoin alkaa! Jerusalem Post uutisoi kolmospiikkikierroksen jaelleen Israelin alkavan selvittää, mitä pitkäaikaishaittavaikutuksia koronapiikeillä on:
Israeli experts analyze mRNA COVID vaccines long-term effects
Experts believe there will be no long-term side effects to the mRNA vaccines.
https://www.jpost.com/health-and-wellness/israeli-experts-analyze-if-mrna-covid-vaccines-be-dangerous-in-long-term-678171
Sananvastuullisena ihmisenä pidättäydyn (ponnistaen ja vaivalloisesti) lausumasta, mitä ajattelen hallituksista, kv. organisaatioista, kansanterveyden huollosta, asiantuntijoista, koronatukimediasta jne
— veikkaan, että silti moni suomalainen kykenee ajatustenlukuun kohdallani tässä asiassa 😀
TykkääTykkää
Nuo jotka luettelit ovat rikollisia, jotka täytyisi tuomita pitkiin vankeusrangaistuksiin. Toivottavasti oikeus joskus toteutuu
TykkääTykkää
Tämä lainaus on Fimean valehtelua:
”Tarkempaa käsittelyä odottavia koronarokotehaittailmoituksia on n. 11 000, joista pääosin ilmoittajan vakavaksi luokittelemia on noin 520. ”
Ilmoittaja ei luokittele ilmoitustaan vakavaksi tai joksikin muuksi, vaan sen tekee Fimean järjestelmä tai ihminen. Blogissani on asiasta Vesa Raiskilan analyysi:
https://www.ossitiihonen.com/2021/09/01/eiko-fimean-johto-tunne-omia-jarjestelmiaan/
TykkääTykkää
Meillä myös on Vesa Raiskilan artikkeli julkaistuna.
TykkääTykkää
Jokainen asiantuntija on tästä yksimielinen. Kaikki olemassa oleva tieto tukee tätä. Jos hemoglobiini arvosi ovat yli 150, olet ääri riskiryhmässä saada veritulppa kuten minä. Ymmärrän toki, että +150 hemoglobiini arvot ovat harvinaisia ja ovat joko perinnöllisiä tai huippu-urheilun aiheuttamia, mutta kyllä meitä olisi pitänyt varoittaa. Miksi hapenottokyvyltään kykenevin kansanosa halutaan murhata?
TykkääTykkää
Niin olisi. Pelkästään siksi, että potilaslaki edellyttää informoitua, tietoista suostumusta.
TykkääTykkää
Alan diggailla pres. Jair Bolsonaron ulosantia tässä koronapiikki-asiassa
TykkääTykkää
Olisipa meilläkin yhtä hieno presidentti. Mutta meillä on sale…..Agenda2030 kannattaja, ei ansaitse nimeään kirjoitettavan isolla.
TykkääTykkää
Seuraukset Suomessa & lapsiin liittyen:
Nohynek @ Sensuroimaton Päivärinta 25.8.:
12-15-vuotiaita on joutunut sairaalahoitoon pandemian aikana noin 10, tehohoitoon ei yhtään.
Tieto on siis tullut julkisuuteen n. 2 viikkoa sen jälkeen, kun 12-15-vuotiaiden rokotukset oli aloitettu.
TykkääTykkää
Ajoitus tuskin on vahinko. On päätetty olla antamatta perusteita kieltäytymiseen piilottamalla se, että tauti ei ole lapsille vaarallinen.
TykkääTykkää
Itse asiassa tuokin tieto tuli vasta sitten esille kun joku toimittaja (tässä tapauksessa siis Päivärinta) sitä tajusi erikseen kysyä, tai no, taisi joutua kysymään jopa kahdesti ennen kuin Nohynek vastasi 12-15-vuotiaiden osalta. Olen Twitterissä kysynyt pariinkin kertaan THL:ltä tuota asiaa ja ”kirjallisena” vastausta ei kuulu. Ilmoittavat tiedot aina vain noiden kaikkien alle 20-vuotiaiden osalta. Ainoa lähde on tietääkseni tuo yksi ainoa haastattelu.
TykkääLiked by 1 henkilö
Oletko huomannut, että lukuja ilmoitetaan pandemiajulistuksen alusta asti, ei verrokkivuosiin/jaksoihin jaettuna, ja myös että kun normaalisti tilastoinnissa jaotellaan 0-ikävuodesta ylöspäin, niin nyt ilmoitetaan ”alle 50-vuotiaat” –ja tähän siirryttiin 12-15 vuotiaiden piikitysten alettua?
—
Kysyin maaliskuussa kuvan kanssa THL:ta, miksi nenäkidutustikkuja on kahta laatua: negatiivisia ja positiivisia. Eivät ole vielä ehtineet vastata.
Kuvan olen laittanut kuvituksena Antti Heikkilän kirjoittamaan Pandemia-tekstiin. https://avoin.media/2021/05/15/pandemia/
TykkääTykkää
Yhtään alle 30 v ei ole kuollut.
Jos nyt on n. 1300 ei vakavaa ja 2400 vakavaa haittaa, niin millähän laskuopilla 11 000 käsittelemättömästä tapauksesta olisi 520 vakavaa haittaa?? Vakavia haittoja kun on joku 60%.
TykkääTykkää
Fimean laskuopilla. Vähän niin kuin THL:n laskuoppi tai hallituksen laskuoppi; 2 + 2 = 5.
TykkääTykkää
”Suomessa on siis hyväksytty lakimuutos tietäen kokeellisella mRNA-geeniteknologialla koronapiikitettyjen mahdollisesti väestölle muodostama bioriski, ja tietäen, että koronapiikitykset eivät pysäytä väitettyä epidemiaa vaan että seuraus saattaa olla päinvastainen.”
Päättäjät siis TIESIVÄT etukäteen että ns. rokote ei pysäytä plandemiaa, ja silti vieläkin, haitoista ja kuolemista huolimatta, painostavat ihmisiä ottamaan myrkkypiikin!
Marinin hallitus on kansanmurhaaja-hallitus!
TykkääTykkää
Kyllä tiesivät — osa kansanedustajista halusi vieläpä pakkorokotuksia
TykkääTykkää
Näiden nimet pitää saada julkisuuteen ettei kukaan vahingossa äänestä tuollaisia Mengeleitä!
Miten voi olla eduskunnassa noin sivistymätöntä porukkaa, etteivät tunne perustuslakia, ihmisoikeuksia eikä Nurnbergin sopimusta? Kurvinen nyt ainakin näyttää olevan tällainen natsi-mengele.
TykkääTykkää
https://avoin.media/2021/02/04/pakkorokottaja-galleria/ ja jokainen, joka äänesti tuon HE49/2021 hyväksymiselle Jaa.
TykkääTykkää
Eli 8 avoimesti Mengeleä, ja pitkä lista niistä jotka haluaa pitää mengeleytensä? salassa:
Kysymykseen eivät vastanneet
– SDP Sanna Marin, Antti Rinne, Timo Harakka, Erkki Tuomioja, Ville Skinnari, Maria Guzenina, Tuula Haatainen, Marko Asell, Kim Berg, Johan Kvarnström ja Suna Kymäläinen
– KESK Annika Saarikko, Mika Lintilä, Matti Vanhanen, Juha Sipilä, Eeva Kalli, Tuomas Kettunen, Antti Kurvinen ja Jari Leppä
– VIHR Maria Ohisalo, Pekka Haavisto, Hanna Holopainen, Heli Järvinen, Krista Mikkonen ja Pirkka-Pekka Petelius
– VAS Aino-Kaisa Pekonen, Li Andersson, Paavo Arhinmäki, Jussi Saramo, Hanna Sarkkinen, Jari Myllykoski ja Katja Hänninen
– KOK Antti Häkkänen, Elina Lepomäki, Juhana Vartiainen, Wille Rydman, Jaana Pelkonen, Janne Heikkinen, Kalle Jokinen, Saara-Sofia Sirén, Ruut Sjöblom ja Heikki Vestman
– PS Jussi Halla-aho, Sebastian Tynkkynen, Tom Packalén, Juho Eerola, Olli Immonen, Jari Koskela, Juha Mäenpää, Sakari Puisto, Jenna Simula, Ville Tavio ja Ville Vähämäki
– RKP Anna-Maja Henriksson, Thomas Blomqvist, Mats Löfström, Anders Norrback och Mikko Ollikainen
– KD Sari Tanus
Aika monta WEF:läistä.
https://pbs.twimg.com/media/E0ISMQcWYAIjKGy?format=jpg&name=medium
TykkääLiked by 1 henkilö
Israelin ja Islannin tuoreet statsit kertovat karua tarinaa
TykkääTykkää
Haluan kiinnittää huomionne tähän HE49/2021 vp:n kohtaan ”2) tuottajan tai maahantuojan kaupalliset yhteydet toiminnanharjoittajaan tai luvan haltijaan;”
Luetteko te sen niin, että maahantuoja on viime kädessä valtio hallituksen päätöksellä, ja koska valtiot ovat maksaneet ”kehittelykulut”, valtiot ovat tuottajia?
Aiotaanko tällä livetä haittavastuusta?
TykkääTykkää
Kyllähän se niin on että maksaja on tuottaja.
TykkääTykkää
Katselin aamulla Geert van der Bosschen haastattelua, jota avattiin Highwiressa. Haastattelu selittää, miksi rokotetut sairastuvat mutta myös sen rikoksen suuruuden, mikä ihmiskunnalle on nyt tehty näillä geeniteknologialaeilla ja -piikeillä.
https://rumble.com/vlvhy5-best-explanation-ive-seen-about-why-the-covid-jabs-are-killer-shots.html
TykkääTykkää
Tuo löytyy myös suomennettuna rapsodiast, samoin se alkuperäinen ilman Del Bigtreen selitystä:
https://rapsodia.fi/rokotekehittajan-varoitus-rokote-tuhoaa-immuniteettisi-g-bossche/
TykkääTykkää
[…] Söyring on kirjoittanut jutun ”Haluatko tietää, mitä hallitukset ovat sopineet rokotevalmistajien kanssa?”. Siinä kerrotaan geenitekniikkalain muutoksesta sekä hallitusten järjettömistä […]
TykkääTykkää
Toivottavasti joutuvat vankeuteen. Aivan mieletöntä.
TykkääTykkää
Totuus esiin kiitos
TykkääTykkää
”Nythän koronapiikeillä ei ole myyntilupaa, ainoastaan väliaikainen eräkohtainen hätätilakäyttölupa (EUA).”
Mites, kun EU:n omien nettisivujen mukaan nimenomaan yhdelläkään rokotteella ei ole hätäkäyttölupaa, vaan neljälle rokotteelle on myönnetty ehdollinen myyntilupa? Tuo taitaa muuttaa koko pitkän analyysisi miltei vastakohdakseen.
TykkääTykkää
EMA käyttää ns.rolling evaluation -menettelyä. Näiden koronapiikkien kanssa on niin että edelleen testivaiheessa olevien piikkien käyttö oikeutettiin hätätilalla, eli piikille annettiin EUA (Emergency Use Approval, joissain maissa Emergency Use Authorization) vaillinaiseen dataan nojaten. EUA on auktorisoimattoman tuotteen hätätilakäyttölupa, ei myyntilupa. EUA on monissa maissa käytössä oleva nimitys, ja se esiintyy EU-papereissakin vilahdellen.
EU:ssa EMA voi saatavilla olevan (siis vaillinaisenkin) datan arvioinnin perusteella suositella ehdollista myyntilupaa (Conditional Marketing Authorisation, CMA). CMA on EU-lainsäädännön mahdollistama, hätätilan aikana käytettävä nopeutetun hyväksymisen menettely, mutta se ei ole myyntilupa tai lopullinen hyväksyminen, se on hätätilalla oikeutettu käyttö- ja ”myynti”lupa. CMA ei käytännössä (minun mielestäni) eroa vaikutuksiltaan EUA:sta.
CMA:n saannin jälkeen tuotetta seurataan riski-hyötysuhteen selvittämiseksi (vaihe voi kestää pitkään).
CMA-vaiheen jälkeen, jos liian moni ei kuole tai vammaudu, valmistaja/myyjä voi hakea myyntilupaa (Marketing Approval) ja saada sen.
EMA on suositellut CMA-lupaa, ja komissio on sen myöntänyt (koska muuten ostettuja koronapiikkejä ei olisi voitu jaella EU:ssa). Käytännössä siis hätätilalla oikeutetun ehdollisen, väliaikaisen käyttöluvan eli EUAn.
Akronyymista ja menettelystä/prosessin kiemuroista riippumatta päämäärä — ottaa jokin käyttöön — on sama.
EUA-nimityksen käyttäminen on minusta selkeämpi kuin CMA, joka antaa ymmärtää myyntilupaa.
Tästä kyllä saa halutessaan aikaan semanttisen sodan 😀
TykkääTykkää
Kiitos vastauksesta, joka kuitenkin on todella erikoinen. Ollaan aika kaukana semanttisesta erosta, kun kyse on nimenomaan siitä, kenellä on vastuu. Kyllä, molemmat – ehdollinen myyntilupa (CMA) ja hätätilalupa (EUA) – perustuvat hätätilaan, mutta siihen niiden yhteneväisyydet näyttävät jäävän. Ehdollisessa kerrallaan vuoden voimassa olevassa myyntiluvassa vastuu on myyjällä:
”EU:n ehdollisen myyntiluvan tapauksessa vastuu on myyntiluvan haltijalla. Myyntiluvan haltija vastaa tuotteesta ja sen käytön turvallisuudesta.
Ehdollinen myyntilupa on voimassa yhden vuoden ajan, se voidaan uusia ja sen haltijaan sovelletaan samoja oikeuksia ja vastuuta kuin tavanomaisen myyntiluvan haltijaan. Ehdollisen myyntiluvan haltijalla on lisäksi erityisiä velvoitteita, kuten velvoite saattaa päätökseen tai suorittaa uusia tutkimuksia tietyn ajan kuluessa sen varmistamiseksi, että hyöty-riskisuhde on edelleen positiivinen.”
Lisäksi ehdolliseen myyntilupaan edellytetään:
”Esimerkiksi turvallisuuden ja tehon osoittavien tietojen lisäksi koronavirusrokotteen myyntilupahakemuksessa toimitettuihin tietoihin on sisällyttävä seuraavat tiedot:
– ihmisryhmät, joille rokotetta on tarkoitus antaa
– rokotteen farmaseuttinen laatu ja puhtaus
– erien valmistus ja valvonta
– laboratoriotestausta ja kliinisten lääketutkimusten suorittamista koskevien kansainvälisten vaatimusten noudattaminen
– immuunivasteen tyypit
– sivuvaikutukset esimerkiksi ikääntyneillä henkilöillä tai raskaana olevilla naisilla
– myyntipäällysmerkinnät ja pakkausseloste
– riskien hallinta ja seuranta rokotteen hyväksymisen jälkeen.”
Hätätilaluvassa, joka _ei_ole_myyntilupa_ ja josta siis _ei_ ole kyse koronarokotuksissa, vastuu on valtiolla:
”Kun kyseessä on hätätilannekäyttöön myönnettävä lupa sellaisen lääkkeen jakelun sallimiseksi väliaikaisesti, jolla ei ole myyntilupaa (direktiivin 2001/83 5 artiklan 2 kohta), EU:n lainsäädännössä edellytetään, että jäsenmaat vapauttavat valmistajan ja myyntiluvan haltijan hallinnollisesta ja siviilioikeudellisesta vastuusta, kun jäsenmaa suosittaa tai edellyttää tällaista hätätilannekäyttöä.”
Nyt koko mittava analyysisi puhuu jälkimmäisestä, kun koronarokotteita koskee edellinen.
Minusta selkeämpää olisi puhua totta, eli siitä luvasta, joka rokotteilla on, eikä ainakaan tietoisesti valehdella. Tietoista valehtelua on myös se, jos ei näkyvästi ja selkeästi korjaa jakamaansa väärää infoa.
Sitaatit sivulta:
https://ec.europa.eu/info/live-work-travel-eu/coronavirus-response/safe-covid-19-vaccines-europeans/questions-and-answers-covid-19-vaccination-eu_fi?fbclid=IwAR3-r8gqnAu_ILqTHK4sbPZ5WDF6bWKI9WoeMAfkgncXc8e8cnOpF0AYvmQ#authorisation
TykkääTykkää
Lupa loppui, onkohan jatkolupa hankittuna?
TykkääTykkää